细菌感染是当今全球范围内公共健康面临的严峻挑战之一,它引发众多疾病并造成大量死亡。在抗生素的广泛普及下,耐药细菌持续传播,使得细菌感染的治疗工作愈发艰难。部分细菌能够在细胞内存活和增殖,这不仅使它们对常规抗生素有极强耐受性,还能躲避免疫系统清除,从而引发慢性感染,进一步增加抗生素耐药风险。此外,胞内细菌感染还可能导致免疫系统被持续激活,进而引发慢性炎症,削弱宿主对其它病原体感染的抵抗力,甚至诱发自身免疫疾病或多器官衰竭。
目前,针对细胞内细菌感染的新型诊疗策略主要包括功能分子修饰、代谢标记以及噬菌体-DNA偶联等方法。其中,部分功能分子具备穿透哺乳动物细胞膜并杀灭胞内细菌的能力,但其细菌识别能力仅限于区分革兰氏阳性菌和革兰氏阴性菌,难以精准识别特定的病原体。此外,代谢标记策略利用炔基功能分子与叠氮修饰的肽聚糖进行特异性点击反应,以实现对细菌的标记。然而,该过程耗时较长,标记效率较低,难以满足急性感染期的快速诊断和治疗需求。因此,发展更加高效、精准且稳定的诊疗一体化分析方法,对于彻底治愈感染、减少抗生素耐药、降低传播风险以及保护免疫系统具有至关重要的意义。
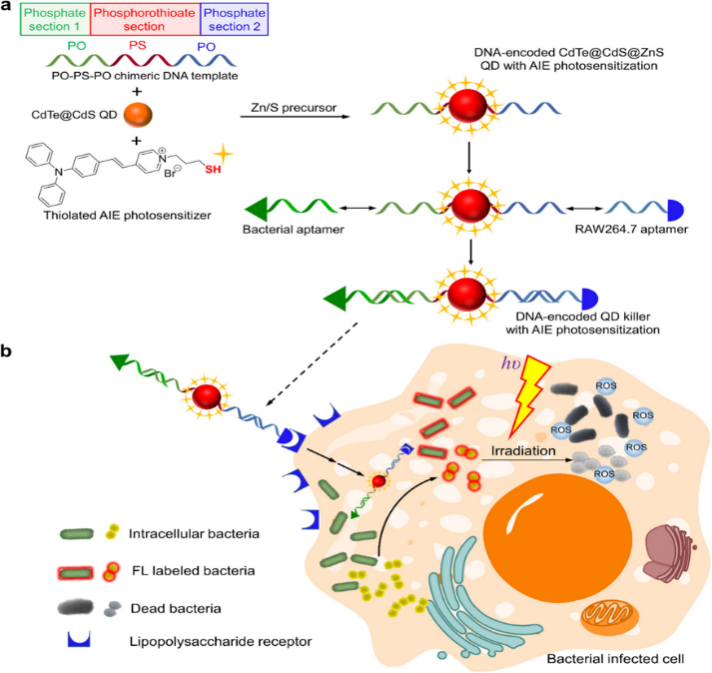
为解决这一问题,我院营养与食品卫生系熊玲红副教授联合香港中文大学(深圳)唐本忠院士以及苏州大学何学文教授团队开展了相关研究,近日在ACS Nano上发表了题为“Photosensitizing Quantum Dot Killers Encoded by Bivalent DNA for Sequential Cell Penetration , Intracellular Bacterial Imaging,and Targeted Elimination”的论文,该研究设计了一种聚集诱导发光(AIE)光敏剂敏化的异质二价核酸编码的多功能量子点探针,该探针能够通过脂多糖受体介导的内吞作用进入巨噬细胞,同时能够靶向成像胞内感染的细菌。锚定在量子点表面的AIE光敏剂能够被量子点发射的荧光敏化,在光照条件下,具有增强的活性氧产生能力,从而实现对胞内细菌增强的光动力杀灭能力,且能够维持宿主细胞的活性。
胞内细菌查杀一体化示意图
本研究创新性地设计了一种含有磷硫(PS)结构域的嵌合DNA模板,其中PS结构域作为量子点生长的模板,两端的磷酸(PO)结构域则用于组装两种靶向基序:一种用于靶向M2型巨噬细胞膜表面脂多糖受体,另一种是用于靶向细胞内细菌。由于硫原子与金属原子的结合能力远高于氧原子,PS结构域能够牢固地结合在量子点表面的金属原子上,而PO结构域能够与其他DNA分子进行杂交,从而实现异质双价DNA编码的量子点探针的层层组装。这种独特的设计使得多功能量子点探针能够通过受体介导的内吞作用依次穿透细胞膜,从而精准靶向细胞内的细菌。此外,量子点表面修饰的巯基AIE光敏剂不仅作为配体稳定量子点,还能够进一步被量子点的发光敏化,实现显著增强的活性氧生成能力,从而提高对细菌的光动力杀灭效果。
这种多功能量子点探针展示出了在体内外对细菌的高灵敏的荧光标记以及高效的抗菌效果,不仅能够杀灭细菌,同时能够加速感染伤口的愈合。体外实验结果表明,该多功能量子点探针表现出极高的特异性,对靶向细菌的标记效率高达100%,并能完全杀灭感染巨噬细胞内的细菌,显著恢复巨噬细胞的活性。体内研究进一步证实,多功能量子点探针成功清除细菌后,感染伤口的愈合速率明显加快。该研究工作开创了对抗胞内细菌感染的新方法,为开发针对胞内细菌感染的新型查杀一体的诊疗剂提供了新思路。
论文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c14792